به گزارش پایگاه خبری تحلیلی تسریر، به نقل از خبرگزاری ایسنا، سرطان خون او بازگشته بود و گزینههای درمانی کوین ساندر(Kevin Sander) رو به اتمام بود. پیوند سلولهای بنیادی بهترین احتمال برای بقای طولانی مدت را ارائه میدهد اما برای واجد شرایط پیوند بودن، ابتدا باید وسعت تومور کوین کاهش مییافت و این یک هدف به ظاهر غیرممکن به نظر میرسید زیرا درمانهای متوالی نتوانسته بودند بیماری او را کنترل کنند.
به عنوان آخرین شانس، او به یک آزمایش بالینی قابل توجه پیوست. این مطالعه که توسط فیلیپ استابر(Philipp Staber) هماتولوژیست در دانشگاه پزشکی وین هدایت میشود، یک استراتژی درمانی نوآورانه را بررسی میکند که در آن داروها بر روی سلولهای سرطانی خود بیمار که در خارج از بدن کشت میشوند، آزمایش میشوند.
در ماه فوریه ۲۰۲۲، محققان ۱۳۰ ترکیب را روی سلولهای رشد یافته از سرطان ساندر آزمایش کردند. اساسا همه چیزهایی را که در اختیار داشتند امتحان کردند تا ببینند چه چیزی ممکن است مؤثر باشد. یک گزینه در این میان امیدوارکننده به نظر میرسید. این گزینه یک نوع مهارکننده کیناز(kinase) بود که برای درمان سرطان تیروئید تایید شده است، اما به ندرت یا هرگز، برای زیرگروه نادر لنفوم مورد استفاده قرار میگیرد.
پزشکان برای او یک رژیم درمانی تجویز کردند که شامل این دارو بود و کارساز شد. سرطان کاهش یافت و او را قادر ساخت که تحت پیوند سلولهای بنیادی قرار گیرد. او از آن زمان در حال بهبودی است. ساندر، یک مدیر تدارکات ۳۸ ساله که اتریش زندگی میکند، میگوید: من اکنون کمی آزادتر هستم. او میافزاید: من دیگر از مرگ نمیترسم. سعی میکنم از زندگی لذت ببرم.
داستان او گواهی بر این نوع روش فشرده و بسیار شخصی سازی شده برای غربالگری دارویی است که از آن به عنوان «پزشکی دقیق عملکردی» یاد میشود. هدف آن تطبیق درمان با بیماران است اما با پارادایم هدایت ژنومیک که در این زمینه تسلط یافته است، متفاوت است. در این روش به جای تکیه بر دادههای ژنتیکی و بهترین درک موجود از بیولوژی تومور برای انتخاب درمان، پزشکان هر آنچه را که دارند روی سلولهای سرطانی در آزمایشگاه امتحان میکنند تا ببینند چه چیزی موثر واقع میشود.
اما چیزی که گاهی اوقات فاقد ظرافت است، میتواند نتایج را جبران کند. در مطالعات آزمایشی، استابر و همکارانش دریافتند که بیش از نیمی از افراد مبتلا به سرطان خون که درمان آنها با آزمایش داروی عملکردی هدایت میشد، از دورههای بهبودی طولانیتری در مقایسه با کسانی که از درمانهای سنتی بهره میبردند، برخوردار شدند.
آزمایش در مقیاس بزرگ رویکردهای ژنومی نشان میدهد که این روشها در برابر برخی سرطانها بسیار مؤثر هستند، با این حال، در مجموع تنها برای حدود ۱۰ درصد از بیماران نفع دارند. جدیدترین کارآزمایی استابر و گروهش اولین آزمایشی است که رویکردهای هدایتشده عملکردی و ژنومی را در کنار درمانهایی که توسط آسیبشناسی استاندارد و شهود پزشک هدایت میشوند، مقایسه میکند.
آنتونی لتای(Anthony Letai)، هماتولوژیست در موسسه سرطان دانا-فاربر در بوستون، ماساچوست و رئیس انجمن پزشکی دقیق عملکردی میگوید: این یک مطالعه بسیار قدرتمند خواهد بود و احتمالا کاربرد این سنجشهای عملکردی را تأیید میکند.
شرکتها در سراسر جهان در حال حاضر این نوع خدمات شخصیسازی شده برای آزمایش دارو را ارائه میکنند. اما طرفداران این استراتژی هنوز موارد زیادی برای اثبات دارند. اگرچه مفهوم غربالگری دستهای از داروها ساده به نظر میرسد، روشهای مورد استفاده برای کشت سلولهای سرطانی در خارج از بدن میتواند از نظر فنی سخت، زمانبر و پرهزینه باشد.
چالش ها به طور ویژه برای تومورهای جامد که در محیطهای پیچیده داخل بدن زندگی میکنند، سختتر میشود. شبیهسازی آن محیط کار آسانی نیست. محققان روشهای متفاوتی را امتحان میکنند که از رشد نمونههای تومور در موشها و جنینهای مرغ گرفته تا کشت ارگانوئیدهای مهندسیشده دقیق و حتی تحویل بینهایت داروی مختلف به یک تومور در حالی که هنوز در بدن یک بیمار است را شامل میشود.
کریستوفر کمپ(Christopher Kemp)، زیست شناس سرطان در مرکز سرطان فرد هاچینسون در سیاتل، واشنگتن میگوید: تشخیص اینکه چه چیزی با توجه به هزینه و مقیاس جواب میدهد و چه چیزی عملی است، آسان نخواهد بود اما این یک انقلاب است. بیماران خواستار این رویکرد هستند.
در پشت صحنه چه میگذرد؟
در پایین یک راهرو طولانی، فراتر از مجموعهای از درهای نارنجی رنگ، بانک ویوی (Vivi-Bank) در دانشگاه پزشکی وین قرار دارد. این عبارت مخفف کلمه «Viable Biobank» به معنای بانک زیستی با دوام است و اتاقی مملو از بشکههای نیتروژن مایع است که هر کدام حاوی نمونههای لنفوم منجمد هستند.
هنگامی که جراحان نمونههای غدد لنفاوی سرطانی را استخراج می کنند، معمولا بافت را در فرمالدئید غوطهور میکنند تا برای آنالیزهای آسیبشناسی استاندارد آماده شوند. با این حال، این کار سلولها را میکشد و آنها را برای آزمایش عملکردی بیفایده میکند.
بنابراین، برای ممکن کردن فرآیند غربالگری دارو، استابر و اینگرید سیمونیچ-کلاپ (Ingrid Simonitsch-Klupp)، هماتوپاتولوژیست که به طور مشترک بر بانک ویوی نظارت میکنند، مجبور شدند همکاران جراح خود را متقاعد کنند که روش خود را تغییر دهند، بافت را زنده نگه دارند و به سرعت برای پردازش و ذخیره سازی ارسال کنند. سیمونیچ میگوید: بافت تازه مهمترین چیز است.
بخشی از این بافت به آزمایشگاه استابر میرسد، در آن جا محققان با استفاده از یک چاقو، پنس و یک صافی نایلونی سلولها را میشکنند و مادهای آبکی را برای توزیع در یک ظرف ۳۸۴ چاهکی ایجاد میکنند.
در هر چاهک، آنها ترکیب دارویی متفاوتی را آزمایش میکنند که شامل عوامل شیمی درمانی، داروهای هدفمند آنزیمی، درمانهای تعدیل کننده سیستم ایمنی و موارد دیگر میشود. پس از یک شب انکوباسیون یا قرار دادن در شرایط مناسب محیطی از نظر رطوبت و دما، آزمایشها نشان میدهد که کدام داروها علیه سرطان فعال هستند و کدامها نیستند.

ظرف چند چاهکی یک ظرف آزمایشگاهی دارای سوراخهای کوچک است که با فاصله یکسان از هم قرار گرفتهاند. گروهی از پزشکان از این اطلاعات برای تعیین مناسبترین دوره درمانی برای هر بیمار استفاده میکنند.
چندین گروه دستیابی به موفقیت را با این رویکرد کلی گزارش کردهاند. برای مثال، در آزمایشی از دانشگاه هلسینکی، محققان دریافتند که غربالگری دارویی سلولهای لوسمی بهطور قابل توجهی سریعتر از پروفایل ژنومی نتایج آموزندهای ارائه میدهد و همچنین پاسخهای بالینی چشمگیری را به همراه دارد. از ۲۹ نفر مبتلا به لوسمی حاد میلوئیدی مقاوم به درمان(AML)، ۱۷ نفر به درمانهای مبتنی بر غربالگری دارویی پاسخ دادند و در مرحله بهبودی قرار گرفتند.
به همین ترتیب، کندیس هاوارد(Candace Howard)، رادیولوژیست در مرکز پزشکی دانشگاه میسیسیپی در جکسون، و همکارانش مطالعهای را در سال گذشته منتشر کردند که نشان میداد افراد مبتلا به تومورهای مغزی تهاجمی زمانی که رژیمهای شیمی درمانی آنها توسط آزمایشها هدایت میشود نسبت به زمانی که درمان آنها توسط شهود یک پزشک به تنهایی هدایت میشود، عمر طولانیتری دارند و هزینههای سالانه کمتری برای مراقبتهای بهداشتی صرف میکنند.
جاگان والوری(Jagan Valluri)، زیستشناس سلولی در دانشگاه مارشال در هانتینگتون، ویرجینیای غربی، که شرکتی به نام کوردجنیکس(Cordgenics) را که در هانتینگتون مستقر است برای تجاریسازی روش مورد استفاده در کارآزمایی هاوارد، تأسیس کرد، میگوید: این ارزانتر و مؤثرتر است.
آزمایش عملکردی دارو ایده جدیدی نیست. این روش در اواخر قرن بیستم توسط محققان سرطان مورد استقبال قرار گرفت، اما زود توجهها از آن برداشته شد. علت آن محدودیتهای سنجش در آن زمان و مجموعهی محدود داروهای ضد سرطان بود. پیشرفتهای فناوری و فهرستهای کامل گسترش یافته داروها این موضوع را تغییر داده است. با این حال، مانند اکثر سیستمهای آزمایش مبتنی بر آزمایشگاه، تجهیزات لازم میتواند گران باشد و برای راهاندازی آن به پرسنل آموزش دیده نیاز است.
جوآن مونترو(Joan Montero)، زیستشیمیدان دانشگاه بارسلون در اسپانیا میگوید: این یک محدودیت بزرگ است زیرا مانع از اجرای گسترده آزمایش دقیق دارویی به ویژه در محیطهای کم منابع میشود. برای مقابله با این چالشها، مونترو و همکارانش در حال توسعه دستگاههای میکروسیال ارزان و قابل حمل برای آزمایش سریع و در محل سلولهای سرطانی هستند.


جوآن مونترو(ایستاده) و همکارانش در حال توسعه یک دستگاه میکروسیال ارزان قیمت هستند.
با این حال، پلتفرم میکروسیال آنها سالها تا استفاده عملی فاصله دارد و ممکن است درمان را فقط برای انواع خاصی از سرطان هدایت کند. به این دلیل که پروتکلهای توسعهیافته برای درمانهای مناسب علیه سرطان خون همیشه برای تومورهای جامد پستان، ریه، کبد و سایر سیستمهای اندام ها جواب نمیدهند.
نمونهبرداری از تومورهای جامد اغلب تعداد سلولهای کمتری را فراهم میکند که نیاز به مراحل بیشتری برای کشت سلولها قبل از غربالگری دارویی را ایجاد میکند. علاوه بر این، تومورهای جامد فعل و انفعالات پیچیدهای با سلولهای سالم اطراف خود دارند به این معنی که مدلها باید پیچیدهتر باشند.
درد رو به رشد
اولین چالش، رشد بافت کافی از تومور برای آزمایش است. دیوید زیگلر(David Ziegler)، متخصص مغز و اعصاب اطفال در بیمارستان کودکان سیدنی در استرالیا، تصمیم گرفته بود تا به عنوان بخشی از برنامه سرطان در دوران کودکی، برای حدود ۱۰۰۰ کودک مبتلا به سرطانهای پرخطر، غربالگریهای دارویی جداگانه انجام دهد.
اما در آزمایشها، او و گروهش دریافتند که پس از چند روز تحت شرایط آزمایشگاهی، بیش از یک پنجم نمونههای بیمار یا اصلا سلول سرطانی نداشتند یا سلولهای سالم و طبیعی از سلولهای سرطانی پیشی میگرفتند. محققان به سرعت یاد گرفتند که کشتها را برای یافتن سلولهای تومور بررسی کنند و این کار را از طریق تصویربرداری، تجزیه و تحلیل سلولی یا پروفایل ژنتیکی قبل از آزمایش آنها در برابر داروها انجام دهند.
کشت سلولی از تومورهای جامد، در اصل، میتواند تحت همان نوع آزمایشی قرار گیرد که برای سرطان خون استفاده میشود. اما تعداد فزایندهای از گروههای تحقیقاتی در حال ساخت ساختارهای پیچیدهای هستند که به عنوان ارگانوئیدها شناخته میشوند. تا این مدلهای بافت سهبعدی مشتقشده از بیمار که با رشد نمونههای تومور در داربستهای تخصصی در طول چند هفته برای شبیهسازی معماری بافتی پیچیده یک تومور و در نتیجه نمایش دقیقتری از سرطانی که پزشکان به دنبال درمان آن هستند، ساخته شدهاند را آزمایش کنند.
آلیس سورگنی(Alice Soragni)، زیستشناس سرطان در دانشگاه کالیفرنیا، لسآنجلس، میگوید: ما میخواهیم سلولهای تومور را در محیطی قرار دهیم که تا حد امکان به نحوه رشد آنها در بدن نزدیک باشد.
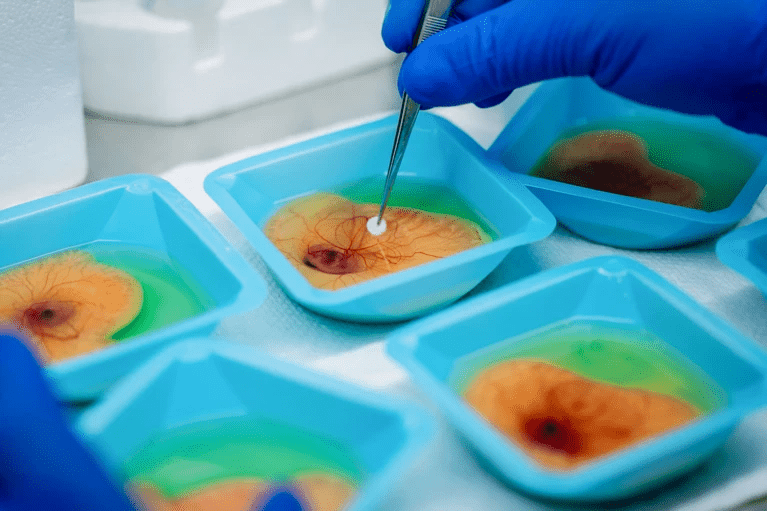

یک محقق جنینهای مرغ در حال رشد را برای ایجاد مدلهایی از تومور آماده میکند.
کارلا گراندوری(Carla Grandori) یکی از بنیانگذاران پزشکی دقیق میگوید: این فرآیند میتواند هفتهها به جدول زمانی ما برای به دست آوردن اطلاعات حساسیت دارویی اضافه کند اما تلاش و سرمایهگذاری اضافی در زمان ارزش آن را دارد.
در مطالعات اعتبار سنجی بالینی، گراندوری و همکارانش دریافتند که نتایج غربالگری دارو با استفاده از ارگانوئیدها با نتایج به دست آمده از بیمار با دقت حدود ۸۰ درصد هماهنگ است.
این یافتهها هنوز منتشر نشدهاند، اما گزارشهای موردی در سال گذشته منتشر شده که در آن افراد مبتلا به سرطانهای سختدرمان را توصیف میکند که پس از به پایان رسیدن گزینههای درمانی، درمانهای غیرمنتظره مؤثری از طریق آزمایش داروها بر روی نمونههای ارگانوئیدی پیدا کردند.
هایدی گری(Heidi Gray)، انکولوژیست زنان در مرکز پزشکی دانشگاه واشنگتن در سیاتل که یکی از این بیماران یعنی زنی مبتلا به سرطان تخمدان را درمان کرد، میگوید: پاسخ او قطعا یکی از بهترینهایی بود که دیدهام. دارویی که آنها امتحان کردند عموما برای درمان سرطان خون استفاده میشود، اما به شکست تومور تخمدان زن برای بیش از یک سال کمک کرد و به او اجازه داد قبل از تسلیم شدن در نهایت به سفر و لذت بردن از وقت گرانبها با عزیزانش بپردازد.
گری میگوید: ما عمیقا کیفیت زندگی او را بهبود بخشیدهایم و این بدون دانش ارائه شده توسط این آزمایش اتفاق نمیافتاد.
مدل کارایی
به امید آزمایش داروها علیه سیستمهای سرطانی واقعیتر، برخی از پژوهشگران ترجیح دادهاند روی موشهایی که نمونههای تومور در آنها کاشت شده است مطالعه کنند.
این «آواتارهای» شخصی سازی شده زمانی به عنوان گام بزرگ بعدی در مراقبت از سرطان معرفی شدند. اما زمان زیادی نگذشت که مشخص شد بسیاری از تومورها در موشها رشد نمیکنند، غربالگری دارو در پیوندهای پودر استخوان برای ارائه توصیههای به موقع بسیار زمانبر است و هزینه این رویکرد که اغلب بیش از ۵۰ هزار دلار آمریکا است، بیشتر از آن چیزی است که بیماران و سیستمهای مراقبت بهداشتی میتوانند از عهده آن بر بیایند.
دیوید سیدرانسکی(David Sidransky)، انکولوژیست در دانشکده پزشکی دانشگاه جانز هاپکینز در بالتیمور، مریلند، و یکی از بنیانگذاران توسعه مدلهای پودر استخوان، میگوید: این روش بسیار کُند و گران بود و به اندازه کافی نیز قوی نبود.
اگرچه برخی از شرکتهای دارویی به استفاده از پیوند پودر استخوان برای تحقیقات ادامه میدهند، و برخی از سرطانشناسان فکر میکنند که موقعیتهای خاصی وجود دارد که این روش میتواند به مراقبت از بیمار کمک کند اما در بیشتر موارد، محققان برای آزمایش عملکردی در کلینیک از موشها استفاده نمیکنند و برخی به سیستمهای زنده دیگر روی آوردهاند.

یکی از این جایگزینها توسط هون لئونگ(Hon Leong)، زیستشناس سرطان و همکارانش در بیمارستان سانیبروک(Sunnybrook) در تورنتو، کانادا ارائه شد که سیستمی برای غربالگری داروها بر روی نمونههای بیوپسی تومور کشت شده روی جنین مرغ در حال رشد ابداع کردند. لئونگ میگوید این رویکرد هم سریع و هم ارزان است و به محققان این امکان را میدهد تا گزینههای دارویی مختلف را در عرض چند هفته به جای چند ماه ارزیابی کنند.
در کارآزماییهای در حال انجام که بر روی سرطانهای پیشرفته پستان و کلیه که به سایر قسمتهای بدن سرایت کردهاند، متمرکز بودند، لئونگ و گروهش با موفقیت از جنین مرغ برای شناسایی افرادی که از درمانهای ایمنی سود میبرند، استفاده کردهاند
رویکرد دیگری از سوی راس کیگان(Ross Cagan)، زیستشناس رشدی در دانشگاه گلاسکو، انگلستان است که از توالییابی ژنومی و مهندسی ژنتیک برای بازسازی ویژگیهای منحصر به فرد تومور بیمار در مگس میوه استفاده میکند.
این کار شامل معرفی اشکال جهشیافته از ژنهای محرک سرطان یا ترکیب توالیهایی است که ژنهای سرکوبکننده سرطان را محدود میکنند. تغذیه مگسها با مواد غذایی حاوی داروهای مختلف میتواند رژیمهای درمانی را مشخص کند که رشد سرطان را سرکوب میکند یا با تأثیر مستقیم روی سلولهای تومور یا تأثیرگذاری غیرمستقیم بر زیستشناسی حیوان مانع پیشرفت سرطان میشوند.
کیگان و همکارانش با همین روش یک ترکیب سه دارویی جدید را شناسایی کردند که شامل یک درمان لنفوم، یک داروی فشار خون و یک درمان التهاب مفاصل بود که وقتی روی مردی با تومور نادر غدد بزاقی آزمایش شد، به جلوگیری از پیشرفت سرطان برای یک سال کمک کرد.
در مورد دیگری که یک مرد مبتلا به سرطان کولون تهاجمی بود، استفاده از آواتارهای مگس، پژوهشگران را به تجویز داروی ملانوما در کنار یک عامل تقویت کننده استخوان هدایت کرد که منجر به کوچک شدن قابل توجه تومور و پاسخ بالینی تقریبا یک ساله شد. یک استارتآپ زیستفناوری در لندن به نام ویوان تراپیتکس(Vivan Therapeutics) اکنون این خدمات سفارشی با استفاده از مگس و غربالگری دارو را با قیمت ۱۵ هزار دلار برای هر بیمار ارائه میکند.
با این حال، هر مدلی همواره دارای محدودیتهای زیستی است، بنابراین برخی از محققان تصمیم گرفتهاند که به طور کامل از پایههای حیوانی یا شبیهسازیهای سلولی خودداری کنند.
به جای آن پژوهشگران دستگاههای کاشتنی ساختهاند که به پزشکان اجازه میدهد داروها را مستقیما روی تومورهای بیمار آزمایش کنند و این کار را زمانی که سرطان هنوز در بدن است انجام دهند.
سال گذشته، الیور جوناس(Oliver Jonas)، مهندس زیستی در بیمارستان زنان و بریگهام در بوستون، و همکارانش امکانپذیری این استراتژی را در افراد مبتلا به سرطانهای ریه و مغز نشان دادند.
در کارآزماییهای کوچک، جراحان دستگاههای کوچک رهاسازی دارو را که هر کدام با نانودوزهای حداکثر ۱۲ دارو بارگیری شده بودند، وارد تومورها کردند در حالی که افراد تحت عمل جراحی برداشتن تومور سرطانی قرار میگرفتند. در طول جراحی، داروها از مخازن جداگانه در دستگاهی به اندازه یک دانه برنج به بافت اطراف سرازیر شدند.
آن بافتها، همراه با خود دستگاه، سپس در پایان عمل برداشته شدند و متعاقبا از نظر شاخصهای مولکولی اثر دارو بررسی شدند. تاکنون، دادههای جمعآوریشده برای راهنمایی درمانها استفاده نشده است، اما تحلیلها به مزایای بالقوهای اشاره میکنند. دو شرکت با مشارکت جوناس اکنون در حال توسعه این نوع پلتفرمهای آزمایش دارو در محل هستند.
فرصتی برای انتخاب
پیشبینیهای نتایج درمانی فقط به اندازه توانایی بیمار در دسترسی به داروهای توصیه شده خوب است و اگر این داروها گران یا تایید نشده باشند هزینهها و بازپرداخت بیمه میتواند مانعی برای بیماران ایجاد کند.
پاملا بکر(Pamela Becker)، متخصص خون در مرکز سرطان شهر امید در دوارت، کالیفرنیا، در تلاش برای تجویز داروهایی که در طول آزمایشهای درمانی هدایت شده برای افراد مبتلا به مولتیپل میلوما و سایر سرطانهای خون شناسایی شده بودند، با برخی از این مشکلات مواجه شده است. او میگوید: من نتوانستم بهترین انتخابم را به دست بیاورم. بکر مجبور شد فهرست توصیهها را کاهش دهد و در نهایت داروهایی را پیدا کند که تحت پوشش بیمه قرار میگیرند.
یکی دیگر از موانع مالی بازپرداخت خود آزمایشهای عملکردی است. مبارزه با چنین سیاستهایی وابسته به در دسترس بودن دادههای بالینی قانعکننده است. اما جمعآوری چنین دادههایی میتواند چالش برانگیز باشد.
استراتژیهای آزمایش عملکردی حتی ممکن است برای شرایط خارج از حوزه سرطان کارساز باشند. به عنوان مثال، در فیبروز کیستیک، مدلهای ارگانوئیدی ساخته شده از بافت رکتوم یا روده شروع به کمک به پزشکان برای یافتن رژیمهای دارویی مؤثر برای افراد مبتلا به جهشهای نادر بیماریزا میکنند که واجد شرایط دریافت هیچگونه درمان تایید شدهای نیستند.
بسیاری از محققان سرطان نیز همین احساس را دارند و اکنون فقط باید آن را به جامعه پزشکی گستردهتری ثابت کنند. بنابراین همه چشمها به استابر و کارآزمایی او معطوف است که پژوهشگران پیشبینی میکنند که این آزمایش تا حد زیادی برای متقاعد کردن پزشکان به این موضوع که ژنومیک منتهای مراقبتهای شخصی نیست، پیش برود.
انتهای پیام