به گزارش پایگاه خبری تحلیلی تسریر، پروتئینهای گلوبولار با توجه به نوع پیچخوردگی (Folding) آنها، انواع مختلفی دارند. ایمونوگلوبولین ها گروهی از پروتئینهای گلبولار سیستم ایمنی هستند که در مبارزه با پاتوژنهای مختلف تولید میشوند.
در این مطلب به توضیح ساختار، عملکرد و مقادیر طبیعی و غیر طبیعی انواع ایمونوگلوبولین پرداختهایم.
پروتئین گلبولار چیست؟
اصطلاح پروتئین کروی احتمالاً مربوط به قرن نوزدهم بوده و امروزه با توجه به کشف صدها هزار پروتئین متنوع کروی و ایجاد واژههای دقیق و توصیفی، تا حدودی قدیمی است. ماهیت کروی پروتئینها را میتوان بدون استفاده از تکنیکهای مدرن و فقط با استفاده از سانتریفیوژ و الکتروفورز یا تکنیکهای پراکندگی دینامیکی نور تعیین کرد. ساختار کروی در واقع شکل سه یعدی و ساختار سوم پروتئین است.
اسیدهای آمینه غیر قطبی (آبگریز) یک زنجیره پروتئینی به سمت داخل مولکول میروند، در حالی که آمینو اسیدهای قطبی (آب دوست) به سمت بیرون متمایل میشوند و امکان تعاملات دو قطبی – دو قطبی با حلال را فراهم میکنند که این فرآیند حلالیت نسبی این پروتئینها را توضیح میدهد.
پروتئینهای کروی فقط از لحاظ حاشیهای پایدار هستند زیرا انرژی آزاد شده در هنگام جمع شدن پروتئین در ترکیب طبیعی آنها نسبتاً کم است چون پیچخوردن پروتئین به انرژی آنتروپی بالاتری نیاز دارد.
از آنجا که توالی اولیه یک زنجیره پلیپپتیدی تعیینکننده ساختمان سهبعدی و فضایی پروتئین است، ایجاد ساختارهای متفاوت محلی در هر قسمت، انتخابهای محدودی ایجاد میکند و این منجر به کاهش تصادفی بودن ساختار آن میشود، اگرچه فعل و انفعالات غیر کووالانسی مانند فعل و انفعالات آبگریز در ساختمان پروتئین ثبات ایجاد میکنند.
بخشی از مشکل پیچ خوردن پروتئین این است که چندین فعل و انفعالات غیر کووالانسی و ضعیف مانند پیوندهای هیدروژنی و فعل و انفعالات واندروالس در آن نقش دارند. بنابراین ممکن است اثر برخی از این نیروها نامطلوب باشد. برای ممانعت از ایجاد ساختار سهبعدی ناقص یا نامناسب در پروتئین، مولکولهای خاصی با نقش شبه آنزیمی به ایجاد این ساختمان کمک میکنند.
برخلاف پروتئینهای رشتهای که فقط عملکرد ساختاری دارند، پروتئینهای کروی میتوانند عملکردهای مختلفی مانند موارد زیر داشته باشند:
- نقش آنزیمی: همهی پروتئینهای آنزیمی کروی هستند و واکنشهای سلولی را کاتالیز و تسریع میکنند.
- نقش پیام رسان: برخی پروتئینها مانند هورمونها، به عنوان پیام برای تنظیم فرآیندهای بیولوژیکی عمل میکنند.
- انتقال دهنده عصبی: انتقالدهندههای عصبی باعث انتقال پیام در سیناپس بین نورونها میشوند.
- انتقال دهنده غشایی: این پروتئینها مانند یک کانال در غشای سلولی قرار دارند و مولکولهای مختلف را بین سلول و فضای خارج از آن انتقال میدهند.
- تنظیم کننده: برخی از پروتئینهای گلوبولار، تنظیمکننده واکنشهای بیولوژیک هستند.
- نقش ساختاری: مانند پلیمرهای اکتین و توبولین که کروی و محلول هستند و الیافهای بلند و محکم را در ساختار مو تشکیل میدهند.
انواع پروتئین های کروی
از جمله پروتئینهای کروی شناخته شده میتوان به هموگلوبین اشاره کرد. سایر پروتئینهای کروی شامل گلوبولین آلفا، بتا و گاما (IgA ،IgD ،IgE ،IgG و IgM) هستند. تقریباً همه آنزیمهای متابولیکی و همچنین بسیاری از پروتئینهای انتقال دهنده سیگنال ساختار کروی دارند. آلبومینها نیز پروتئینهای کروی هستند، اگرچه برخلاف همه پروتئینهای کروی دیگر، آنها کاملاً در آب حل میشوند و در روغن محلول نیستند.
سیستم ایمنی بدن چیست؟
عملکرد سیستم ایمنی محافظت از بدن در برابر عوامل خارجی و ارگانیسمهای عفونی است. این سیستم میتواند یک حافظه طولانی مدت و خاطره از برخورد با پاتوژنها ایجاد کند.
سیستم ایمنی بدن از دو بخش عملکردی تشکیل شده است:
- سیستم ایمنی ذاتی یا غیر اختصاصی
- سیستم ایمنی اکتسابی یا تطبیقی
با ورود هر نوع پاتوژن یا عامل خارجی و بیماریزا به بدن، اجزای مختلف این سیستم به پاتوژنها حمله میکنند. گروهی از سلولهای سیستم ایمنی به نام سلول B، مولکولهایی به نام آنتیبادی یا ایمونوگلوبولین تولید میکنند که با اتصال اختصاصی به گیرنده مربوطه روی عامل بیماریزا (ویروس، باکتری، آلرژن)، باعث مرگ یا شناسایی آن توسط سایر سلولهای سیستم ایمنی میشوند.
گلوبولین چیست؟
گلوبولین دارای اجزای آلفا (α)، بتا (β) و گاما (γ) است و الکتروفورز با وضوح بالا، گلوبولینها را به اجزای پروتئینی به عنوان زیر گروههای α ،β و γ تقسیم میکند. هر یک از سه بخش اولیه گلوبولین حاوی پروتئینهای فعال در شرایط مختلف فیزیولوژیکی و پاتوفیزیولوژیک هستند. در ادامه انواع و زیر مجموعه انواع گلوبولین ها توضیح داده شدهاند.
آلفا گلوبولین چیست؟
آلفاگلوبولینها شامل دو نوع اصلی α۱ و α۲ هستند. در این گروه از گلوبولینها، پروتئینهای التهابی فاز حاد مانند α- لیپوپروتئین، α۱- آنتی تریپسین، α۲- ماکروگلوبین و هاپتوگلوبین وجود دارد. α۲- ماکروگلوبین گاهی به محدوده β مهاجرت میکند. افزایش آلفاگلوبولینها تا حدودی غیر معمول است.
برخی از α۱- گلوبولینها عبارتند از موارد زیر:
- α۱- آنتی تریپسین
- α۱- آنتیسایمو تریپسین
- اوروسوموکوئید (گلیکوپروتئین اسیدی)
- آمیلوئید سرم A
- α۱- لیپوپروتئین
نمونههایی از α۲- گلوبولینها شامل موارد زیر هستند:
- هاپتوگلوبین
- گلوبولین
- α۲- ماکروگلوبولین
- سرولوپلاسمین آلفا- 2u
- گلوبولین متصل به تیروکسین
- آلفا ۲- آنتی پلاسمین
- پروتئین C
- آلفا ۲-لیپوپروتئین
- آنژیوتانسینوژن
- گلوبولین متصل به کورتیزول
- پروتئین متصل به ویتامین D
بتا گلوبولین چیست؟
بتا گلوبولینها، سایر پروتئینهای التهابی فاز حاد را تشکیل میدهند، از جمله β۲- ماکروگلوبولین، فیبرونکتین، ترانسفرین و β- لیپوپروتئین. در برخی از گونهها، یعنی طوطی خاکستری آفریقایی، جز β EPH از دو جز اصلی β۱ و β۲ تشکیل شده است. افزایش سطح بتاگلوبولین ممکن است نشاندهنده بیماری مزمن کبدی یا کلیوی یا بیماریهای التهابی مزمن مانند آسپرژیلوز یا کلامییدوز پرندگان باشد.
شایعترین دلیل افزایش بتا گلوبولین در پرندگان که به عامل ترانسفرین نسبت داده میشود، تولید تخم است. به نظر میرسد افزایش زیاد سطح بتا- گلوبولین، همراه با افزایش ۱/۵ تا ۲ برابر در سطح کلسیم خون، با فعالیت تخم؛ذاری پرنده ماده در ارتباط است.
نمونههایی از بتا گلوبولینها عبارتند از:
- بتا ۲ میکروگلوبولین
- پلاسمینوژن
- آنژیوستاتین
- پرولدین
- گلوبولین متصل به هورمون جنسی
- ترانسفرین
گاماگلوبین چیست؟
گاما گلوبولینها (Gamma globulins) دستهای از گلوبولینها هستند که با موقعیت آنها پس از الکتروفورز پروتئین سرم مشخص میشود. قابل توجهترین گلوبولینهای گاما ایمونوگلوبولین ها (آنتیبادیها) هستند، اگرچه برخی از ایمونوگلوبولین ها گاما گلوبولین نیستند و برخی از گاماگلوبولینها نیز ایمونوگلوبولین نیستند.
در پستانداران، گاما گلوبولینها به عنوان دو بخش اصلی γ۱ و γ۲ ظاهر میشوند. در گونههای پرندگان، فقط یک بخش نشان داده شده است. اجزای اصلی گلوبولینهای گاما آنتیبادیها، محصولات تخریبکننده مکمل هستند. افزایش گاما گلوبولین یک در پرندگان مبتلا به عفونت حاد کلامیدوفیلا پسیتاچی دیده میشود.
تزریق گاما گلوبولین معمولاً برای افزایش موقت ایمنی بیمار در برابر بیماری انجام میگیرد. گاما گلوبولین به عنوان محصولی که از سلولهای مغز استخوان و غدد لنفاوی حاصل میشود، همراه با تزریق خون و استفاده از دارو به صورت وریدی، میتواند هپاتیت C را به دریافتکنندگان منتقل کند. پس از شناسایی هپاتیت C در سال ۱۹۸۹، بانکهای خون شروع به غربالگری کلیه اهداکنندگان خون برای وجود ویروس در جریان خون آنها کردند.
با این حال، از آنجا که هپاتیت C حداقل از دهه ۱۹۴۰ وجود داشته، عکسبرداری گاما گلوبولین قبل از اوایل دهه ۱۹۹۰ دریافتکننده را در معرض خطر ابتلا قرار داده است.
تزریق معمولاً در بیمارانی که در معرض هپاتیت A یا سرخک هستند یا سازگار کردن بدن اهدا کننده کلیه و گیرنده بدون در نظر گرفتن گروه خون یا همخوانی بافتی، استفاده میشود.
از تزریق گاما گلوبولین همچنین برای تقویت ایمنی در بیمارانی که به دلیل نقص ایمنی قادر به تولید گاما گلوبولین به طور طبیعی نیستند، مانند آگاماگلوبولینمی مرتبط با X و سندرم IgM بالا استفاده میشود.
میزان انجام چنین تزریقاتی در عمل پزشکی مدرن کمتر از گذشته هستند و تزریق گاما گلوبولین که قبلاً برای مسافران توصیه میشد، تا حد زیادی با استفاده از واکسن هپاتیت A جایگزین شده است.
از تزریق گاما گلوبولین همچنین برای درمان برخی بیماریهای ایمنی مانند ایدیوپاتیک ترومبوسیتوپنی پورپورا (ITP) استفاده میشود، بیماری که در آن پلاکتها توسط آنتیبادیهای خودی مورد حمله قرار میگیرند و منجر به کاهش شدید تعداد پلاکتها میشود. به نظر میرسد که گاما گلوبولین باعث میشود که طحال پلاکتهای دارای برچسب آنتیبادی را نادیده بگیرد. بنابراین به آنها امکان زنده ماندن و عملکرد میدهد.
گاماگلوبولین وریدی در سال ۲۰۰۴ برای کاهش آنتی بادی در بیمار مبتلا به نارسایی کلیه توسط FDA تأیید شد تا به آن فرد اجازه دهد کلیه را از اهدا کننده با گروه خونی متفاوت (ABO ناسازگار) بپذیرد یا این که یک تطابق بافت غیر قابل قبول است. استنلی جردن در مرکز پزشکی Cedars – Sinai در لس آنجلس پیشگام این درمان بود. در سال ۱۹۵۳، گاما گلوبولین برای جلوگیری از فلج فلج فلج نشان داده شد.
بالا بودن مقدار گاما گلوبولین به عنوان هایپرگاماگلوبولینمی و کمبود آن به عنوان هیپوگاماگلوبولینمی شناخته میشود. بیماری گاما گلوبولین را گاموپاتی مینامند (به عنوان مثال در گاموپاتی مونوکلونال با اهمیت نامشخص.)
ایمونوگلوبولین چیست؟
ایمونوگلوبولین ها که به عنوان آنتیبادی نیز شناخته میشوند، مولکولهای گلیکوپروتئین هستند که توسط سلولهای پلاسما (گلبولهای سفید خون) تولید میشوند.
آنها با شناسایی و اتصال به آنتیژنهای خاص مانند باکتریها یا ویروسها و کمک به تخریب آنها، به عنوان یک قسمت مهم از پاسخ ایمنی عمل میکنند. پاسخ ایمنی آنتیبادی بسیار پیچیده و بسیار خاص است. کلاسهای مختلف ایمونوگلوبولین (ایزوتایپها) از نظر ویژگیهای بیولوژیکی، ساختار، ویژگی هدف و توزیع آنها متفاوت است.
از این رو، ارزیابی ایزوتایپ ایمونوگلوبولین میتواند بینشی مفید در مورد پاسخ ایمنی پیچیده هومورال فراهم کند. ارزیابی و آگاهی از ساختار و کلاسهای ایمونوگلوبولین نیز برای انتخاب و تهیه آنتیبادیها به عنوان ابزاری برای سنجش ایمنی و سایر کاربردهای تشخیصی مهم است.
سیستم ایمنی، آنتیبادیها را برای مقابله با باکتریها، ویروسها و آلرژنها تولید میکند. بدن آنتیبادیهای متنوعی به نام ایمونوگلوبولین تولید میکند تا با انواع پاتوژنها مبارزه کند. به عنوان مثال، آنتیبادی برای آبله مرغان همان آنتیبادی برای مونونوکلئوز نیست.
گاهی اوقات، بدن حتی ممکن است به اشتباه آنتیبادی علیه خود ایجاد کند مانند اندام مهاجران خارجی، اندام و بافتهای سالم را درمان کند. به این بیماری بیماری خود ایمنی گفته میشود.
ایمونوگلبولین های محلول و نامحلول
ایمونوگلوبولین به دو شکل وجود دارد:
- آنتیبادیهای محلول
- آنتیبادیهای متصل به غشا (حاوی یک بخش گذرنده از غشای آبگریز)
پیرایش جایگزین (Alternative Splicing) تولید آنتیبادیهای ترشحی و گیرندههای سلول B به سطح را در سلولهای B تنظیم میکند. ایمونوگلوبولینهای متصل به غشای غیر کووالانسی با دو پپتید لوازم جانبی مرتبط هستند و مجموعه گیرندههای آنتیژن سلول B را تشکیل میدهند. اولین گیرندههای آنتیژن بیان شده توسط سلولهای B IgM و IgD هستند.
گیرنده نمونه اولیه آنتیبادی است که سلول B برای تولید آن آماده شده است. گیرنده سلول B (BCR) فقط میتواند آنتیژنها را متصل کند. این هترو دایمر شامل Ig alpha و Ig beta است که سلول را قادر میسازد سیگنال را تولید کرده و به حضور آنتیژنها در سطح سلول پاسخ دهد. سیگنال تولید شده باعث رشد و تکثیر سلول B و تولید آنتی بادی در داخل سلول پلاسما میشود.
انواع ایمونوگلوبولین
بدن ۵ گروه اصلی ایمونوگلوبولین را تولید میکند که شامل igA ،igE ،igG ،igM، igD هستند. ایمونولوژی یا ایمنیشناسی به چگونگی عملکرد سیستم ایمنی بدن و اجزا و بیماریهای مرتبط با ایمنی میپردازد.
ige چیست؟
IgE با زنجیرههای سنگین ε از سایر کلاسهای آنتی بادی (IgM ،IgD ،IgG و IgA) متمایز میشود. خوشه ژنی ایمونوگلوبولین با زنجیره سنگین شامل بخشهای ژنی رمزگذار منطقه ثابت زنجیره ε (Cε) در کروموزوم ۱۲ موش و کروموزوم ۱۴ در انسان یافت میشود. ویژگی آنتیژن یک کلون سلول B با تشکیل یک ژن عملکردی زنجیره سنگین μ، به دنبال ترکیب جدید مولد (VDJ) و بخشهای ژن Cμ تعیین میشود.
ارتباط با زنجیرههای سبک منجر به بیان IgM و IgD در سلول میشود. پس از تحریک سلول B، ژن بازآرایی شده ممکن است مجدداً در درون خوشه ژنی زنجیره سنگین بازآرایی شود و در نتیجه همان جاگذاری توالی VDJ به منطقه C (که یک آنتیبادی از یک کلاس غیر از IgM را رمزگذاری میکند) باشد.
سوئیچینگ زنجیره سنگین ممکن است به Cγ (برای IgG)، به Cε (برای IgE) یا به Cα (برای IgA) هدایت شود که همگی در پایین دست Cμ قرار دارند. این یک گام ضروری در بیان کلاس آنتیبادی جدید است. توابع موثر مشخصه IgG ،IgE و IgA، توسط گیرندههای Fc در انواع مختلف سلولها که توزیع بافتی و عملکردهای متفاوتی در ایمنی دارند، شناخته میشوند.
تولید IgE از اوایل هفته ۱۱ در کشتهای بافت جنینی انسان مشاهده شده است اما تعیین میزان زودرس بودن بارداری در جنین برای تولید آنتیبادی IgE توسط سرعت پایین انتشار IgE مادر در مایع آمنیوتیک تعیین میشود.
رونوشتهای رده زایا (Germline) برای زنجیره ε IgE در اوایل ۷ تا ۱۰ هفته قابل تشخیص هستند و سلولهای B که برای تولید IgE تحت کلاس تعویضی قرار میگیرند، میتوانند IgE را تا ۲۰ هفته بارداری تولید کنند.
به طور معمول، در کشورهای پیشرفته IgE تا کمی بعد از تولد تولید میشود. تولید محدود IgE ظاهراً با مواجهه محدود آنتیژنیک جنین ارتباط دارد. در کشورهای پیشرفته، کمتر از ۱ درصد نمونههای سرم بند ناف حاوی آنتیبادیهای قابل تشخیص IgE به مواد حساسیتزای رایج است و برخی از IgEهای خاص آلرژن شناسایی شده، میتوانند منشا مادری داشته باشند.
اما IgE اختصاصی آلرژن به ندرت در آنتیبادیهای IgE در سرم بند ناف نشان داده شده است. غلظت IgE سرمی پس از تولد به تدریج افزایش مییابد و در سنین ۱۰ تا ۱۵ سالگی به حداکثر میرسد. بعد از رسیدن به حداکثر مقادیر در اوایل نوجوانی، سطح IgE در بزرگسالی کاهش مییابد.
میزان کاهش IgE در بزرگسالان در مطالعات مختلف متفاوت است، از جمله جنسیت و سیگار کشیدن در تفاوتهای مشاهده شده نقش دارند. در کودکان، هیچ تفاوت جنسیتی قابل توجهی در میانگین غلظت IgE سرم مشاهده نشده است اما مردان دارای مقادیر بالای IgE، به طور قابل توجهی بالاتر از زنان هستند. تفاوت جنسیتی در بزرگسالان در برخی مطالعات ممکن است تا حدی ناشی از میزان مصرف سیگار توسط مردان و زنان و اثر افزایش سن باشد.
IgE یک ایزوتایپ غیرمعمول و دارای ظرفیت محافظتی قوی در برابر برخی از عوامل بیماریزا مانند انگل و کرمها است و به دلیل آزاد شدن سیتوکین از سلولهای دارای گیرندههای IgE با میل ترکیبی بالا، اثرات مخربی در پاسخهای آلرژیک دارد.
جمعیت سلولهای B حافظه IgE کم هستند، در حالی که انفجار ترشح IgE در برخی از پاسخهای ایمونولوژیکی یادآور، وجود یک پیش ماده یادآوری کننده در پاسخ ایمنی را نشان میدهد.
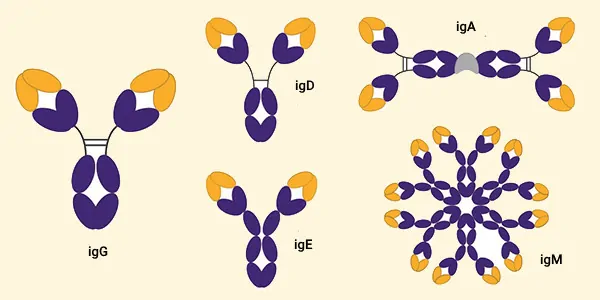

انواع ایمونوگلوبولین
igg چیست؟
حدود ۷۰ تا ۸۰ درصد از ایمونوگلوبولین های خون را IgG تشکیل میدهد. آنتیبادیهای خاص IgG در طی عفونت اولیه یا قرار گرفتن در معرض آنتیژن دیگر تولید میشوند، چند هفته پس از شروع افزایش مییابند، سپس کاهش و تثبیت میشوند. بدن کاتالوگ آنتیبادیهای IgG را در خود نگه میدارد تا وقتی در معرض همان آنتیژن قرار بگیرد، به سرعت آنتیبادیهای مربوطه را باز تولید کند.
- آنتیبادیهای IgG اساس محافظت طولانی مدت در برابر میکروارگانیسمها هستند. در کسانی که سیستم ایمنی سالمی دارند، IgG کافی برای جلوگیری از عفونت مجدد تولید میشود. واکسنها نیز با الگو برداری از همین مکانیسم و قرار دادن فرد در معرض یک میکروارگانیسم ضعیف، زنده یا در معرض یک آنتیژن تحریککننده شناسایی میکروارگانیسم، از این روند برای جلوگیری از عفونتهای اولیه و افزودن به کاتالوگ آنتیبادیهای IgG استفاده میکنند.
- IgG تنها ایمونوگلوبولینی است که میتواند از جفت عبور کند. آنتیبادیهای IgG مادر از جنین در دوران بارداری و از نوزاد در چند ماه اول زندگی محافظت میکنند. چهار زیر کلاس IgG وجود دارد: IgG1 ،IgG2 IgG3 و IgG4.
igG از طریق مکانیسمهای متعددی با عفونت در بدن مقابله میکند که عبارتند از موارد زیر:
- اتصال IgG با واسطه عوامل بیماریزا باعث بیحرکتی و اتصال آنها از طریق آگلوتیناسیون به یکدیگر میشود. پوشش IgG از سطوح پاتوژن (Opsonization) امکان شناسایی و بلع آنها توسط سلولهای ایمنی فاگوسیتیک را فراهم می کند که منجر به از بین بردن خود پاتوژن میشود.
- IgG تمام مسیر کلاسیک سیستم مکمل را فعال میکند، آبشار تولید پروتئین ایمنی که منجر به حذف پاتوژن میشود.
- igG به سموم متصل میشود و سم زدایی را تسریع میکند.
- نقش مهمی در سمیت سلولی وابسته به آنتیبادی (ADCC) و تخریب واسطه آنتیبادی درون سلولی (IAMD) ایفا میکند که در این واکنشها igG به منظور هدایت ویروسهای معین به پروتئازوم موجود در سیتوپلاسم، به یک گیرنده سلولی (TRIM21) متصل میشود.
igm چیست؟
ایمونوگلوبولین M یا Immunoglobulin M) (IgM)) یکی از ایزوتایپهای آنتیبادی (ایمونوگلوبولین تولید شده در بدن مهرهداران) است. ایمونوگلوبولین M بزرگترین و اولین آنتیبادی است که در پاسخ به قرار گرفتن اولیه در معرض آنتیژن تولید میشود.
در مورد انسان و سایر پستانداران که مورد مطالعه قرار گرفتهاند، طحال، جایی که پلاسمابلاستهای مسئول تولید آنتیبادی در آنها ساکن هستند، محل اصلی تولید IgM است.
در سلولهای اسپرم و تخمک، ژنهای کد کننده ایمونوگلوبولینها به شکل عملکردی نیستند. در مورد زنجیره سنگین، سه بخش از سلولهای زایا مشخص شدهاند که در آنها ژن زنجیرههای V ،D و J با هم پیوند داده میشوند و به DNA رمزگذار منطقه ثابت زنجیره سنگین میپیوندند. در اوایل رگزایی، سلولهای B هر دو زنجیره سنگین μ و δ را بیان میکنند.
بیان مشترک این دو زنجیره سنگین، هریک از دامنه V یکسان به اتصالات جایگزین و سایتهای اضافی پُلی A بستگی دارد. بیان سایر ایزوتایپها (γ ،ε و α) توسط نوع دیگری از بازآرایی DNA، فرایندی به نام سوئیچینگ کلاس ایمونوگلوبولین انجام میشود.
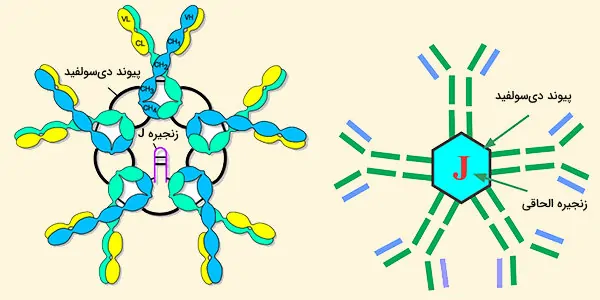

ساختار igM
ساختار igm
ایمونوگلوبولینها شامل زنجیرهای سبک و زنجیره های سنگین است. زنجیره سبک (λ یا κ) یک پروتئین از ۲۲۰ آمینو اسید است که از یک دامنه متغیر به نام VL (شامل تقریباً ۱۱۰ اسید آمینه) و یک دامنه ثابت به نام CL (همچنین به طول تقریبی ۱۱۰ اسید آمینه) تشکیل میشود.
زنجیره سنگین ایمونوگلوبولین M، یک پروتئین از اسیدهای آمینه و شامل یک دامنه متغیر، چهار بخش مشخص (Cµ۱ ،Cµ۲ ،Cµ۳ ،Cµ۴، هر ۱۱۰ آمینو اسید) و یک دم اسید آمینهای است. زنجیره سنگین μ در پنج باقی مانده آسپاراژین، الیگوساکاریدها را تحمل میکند.
الیگوساکاریدهای موجود در موش و IgM انسان تا حدی با انواع تکنیکها از جمله NMR، اتصال به لکتین، سیستمهای مختلف کروماتوگرافی و حساسیت آنزیمی مشخص شده است. هترو دایمر igm از یک زنجیره سبک L و یک زنجیره سنگین ساخته شده است. زنجیرههای سنگین و سبک هر دو توسط پیوندهای دیسولفید و با فعل و انفعالات غیر کووالانسی به هم چسبیدهاند.
بر اساس سرعت رسوب و شکل ظاهری آن در میکروگرافهای الکترونی، IgM عمدتا یک پنتامر یک پلیمر متشکل از پنج مونومر [(μL) 2] 5 با پیوندهای دیسولفید بین حوزههای Cμ۳ و بین قطعات دم است. IgM پنتامریک یک پروتئین سوم، زنجیره J دارد.
زنجیره J به عنوان یک جز پیوند کووالانسی از IgA و IgM پلیمری، یک پروتئین اسیدی کوچک (۱۳۷ اسید آمینه) است و زنجیره J از طریق پیوندهای دیسولفید شامل سیستئین در قسمتهای انتهایی به دو زنجیره میپیوندد.
کار igm چیست؟
ایمونوگلوبولین M با چندین مولکول فیزیولوژیکی دیگر ارتباط برقرار میکند:
- IgM می تواند جزء مکمل C1 را متصل و مسیر کلاسیک را فعال کرده و منجر به opsonization آنتیژنها و سیتولیز شود.
- IgM در فرآیندی به گیرنده پلی ایمونوگلوبولین (pIgR) متصل میشود که IgM را به سطوح مخاطی مانند لومن روده و به شیر مادر میرساند. این اتصال به زنجیره J بستگی دارد.
دو گیرنده دیگر Fc که IgM- Fcα / μ-R و Fcµ-R را متصل میکنند شناسایی شدهاند. Fcα / μ-R مانند pIgR ، پلیمر IgM و IgA را متصل میکند. Fcα / μ-R میتواند واسطه آندوسیتوز باشد و بیان آن در روده نقش مهمی در ایمنی مخاط رودهای دارد.
Fcµ-R (قبلاً با نام Toso / Faim3 شناخته میشد) به طور انحصاری به IgM متصل میشود و میتواند واسطه جذب سلول از آنتیژن متصل شده به IgM باشد. غیرفعالسازی ژنهای مربوطه در موشهای ناک یک فنوتیپ تولید میکند اما عملکردهای فیزیولوژیکی این گیرندهها هنوز نامشخص است.
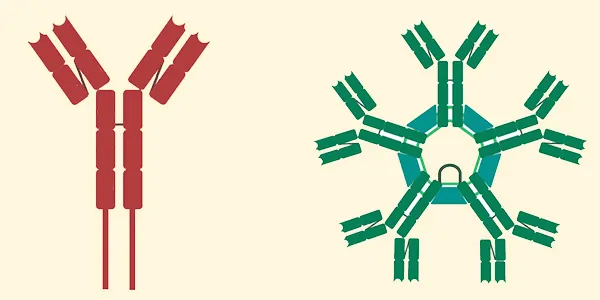

ساختار دو نوع igM، سمت راست نوع ترشحی (پنتامیریک) و سمت چپ نوع غشایی (تریمریک)
ایمونوگلوبولین a چیست؟
ایمونوگلوبولین A که به اختصار IgA نوشته میشود یک آنتیبادی است که نقش مهمی در عملکرد ایمنی غشای مخاطی دارد. مقدار IgA تولید شده در ارتباط با غشاهای مخاطی از همه انواع دیگر آنتیبادیها با هم، بیشتر است. به طور مطلق، هر روز بین سه تا پنج گرم ایمونوگلوبولین A در لومن روده ترشح میشود. این میزان تا ۱۵ درصد از کل ایمونوگلوبولینهای تولید شده در بدن را نشان میدهد.
ایمونوگلوبولین A دارای دو زیر کلاس (IgA1 و IgA2) است و میتواند به صورت مونومر و همچنین به صورت دیمر تولید شود. شکل دیمری IgA شایعترین است و به آن IgA ترشحی (sIgA) نیز گفته میشود. sIgA اصلیترین ایمونوگلوبولین موجود در ترشحات مخاطی از جمله اشک، بزاق، عرق، آغوز و ترشحات از دستگاه تناسلی، دستگاه گوارش، پروستات و اپیتلیوم سیستم تنفسی است. همچنین به مقدار کم در خون یافت میشود.
جزء ترشحی sIgA از ایمونوگلوبولین در برابر تخریب توسط آنزیمهای پروتئولیتیک محافظت میکند. بنابراین، sIgA میتواند در محیط سخت دستگاه گوارش زنده بماند و از میکروبهایی که در ترشحات بدن تکثیر میشوند محافظت کند. sIgA همچنین میتواند اثرات التهابی سایر ایمونوگلوبولینها را مهار کند. IgA یک فعال کننده ضعیف سیستم مکمل است و ضعیف عمل میکند.
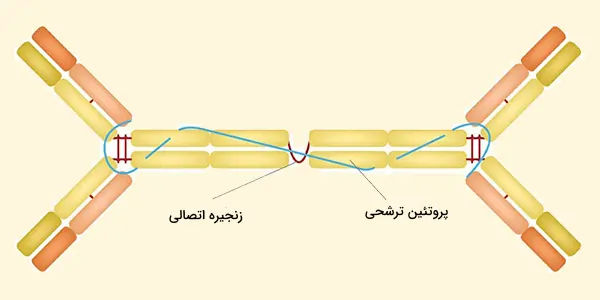

ساختار ایمونوگلوبولین A
انواع ایمونوگلوبولین a
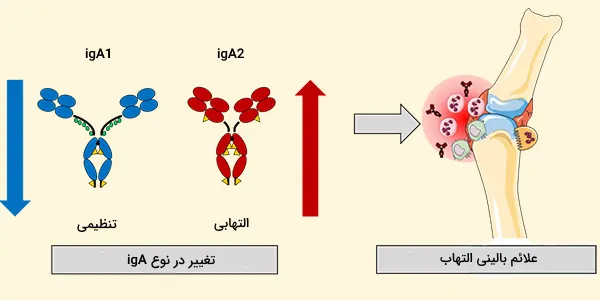
ایمونوگلوبولین A دارای دو ایزوتایپ IgA1 و IgA2 است. هر دو پروتئین به شدت گلیکوزیله هستند. در حالی که IgA1 در سرم غالب است، درصد IgA2 در ترشح نسبت سلولهای ترشحکننده IgA1 و IgA2 در بافتهای مختلف لنفاوی بدن انسان متفاوت است:
- IgA1 زیر کلاس IgA غالب است که در سرم یافت میشود. بیشتر بافتهای لنفاوی غالب سلولهای تولید کننده IgA1 هستند.
- در IgA2، زنجیرههای سنگین و سبک با دیسولفید ارتباط ندارند، بلکه با پیوندهای غیر کووالانسی ارتباط دارند. در بافتهای لنفاوی ترشحی (به عنوان مثال، بافت لنفاوی مرتبط با روده یا GALT)، سهم تولید IgA2 بیشتر از اندامهای لنفاوی غیر ترشحی است (به عنوان مثال طحال، غدد لنفاوی محیطی).
IgA1 و IgA2 در ترشحات خارجی مانند آغوز، شیر مادر، اشک و بزاق یافت میشوند و غلظت IgA2 بیشتر از خون است. آنتیژنهای پلی ساکارید تمایل به IgA2 بیشتری نسبت به آنتیژنهای پروتئینی دارند. IgA1 و IgA2 میتوانند به صورت غشایی متصل شوند. همچنین میتوان اشکال IgA را بر اساس موقعیت آنها (IgA سرم در مقابل IgA ترشحی) از یکدیگر جدا نمود.
در IgA ترشحی، فرم موجود در ترشحات، پلیمرهای ۲ تا ۴ مونومر IgA توسط دو زنجیره اضافی به هم متصل میشوند. به همین ترتیب، وزن مولکولی slgA دالتون ۳۸۵ هزار است.
یکی از اینها زنجیره J است (زنجیره اتصال) که یک پلیپپتید با جرم مولکولی ۱۵ کیلودالتون، غنی از سیستئین و از نظر ساختاری کاملاً متفاوت از سایر زنجیرههای ایمونوگلوبولین است. این زنجیره در سلولهای ترشحکننده IgA تشکیل میشود.
اشکال الیگومریک IgA در ترشحات خارجی (مخاطی) نیز حاوی پلیپپتیدی با جرم مولکولی بسیار بزرگتر (۷۰ کیلودالتون) به نام جز ترشحی است که توسط سلولهای اپیتلیال تولید میشود. این مولکول از گیرنده poly – Ig (130 کیلودالتون) منشأ میگیرد که مسئول جذب و انتقال بین سلولی IgA الیگومریک به سلولهای اپیتلیال و ترشحاتی مانند اشک، بزاق، عرق و مایع روده است.
Iga سرمی
در خون، IgA با یک گیرنده Fc به نام FcαRI (یا CD89) که در سلولهای مؤثر در ایمنی بدن بیان میشود، تعامل میکند تا واکنشهای التهابی را آغاز کنند. اتصال FcαRI توسط IgA حاوی مجتمعهای ایمنی باعث سمیت سلولی وابسته به آنتیبادی سلول (ADCC)، دگرانولاسیون ائوزینوفیلها و بازوفیلها، فاگوسیتوز توسط مونوسیتها، ماکروفاژها و نوتروفیلها و تحریک فعالیت انفجار تنفسی توسط لکوسیتهای چند هستهای میشود.

انواع igA
Iga ترشحی
میزان بالای IgA در نواحی مخاطی نتیجه همکاری سلولهای پلاسمائی است که «گیرنده IgA پلیمری» (pIgA) تولید میکنند و سلولهای اپیتلیال مخاطی که گیرنده ایمونوگلوبولین را به نام «گیرنده Ig پلیمری» (pIgR) بیان میکنند. IgA پلیمری (عمدتاً دیمر ترشحی) توسط سلولهای پلاسما در لامینای مجاور سطوح مخاطی تولید میشود.
این ماده به گیرنده ایمونوگلوبولین پلیمری موجود در سطح بازا-لترال سلولهای اپیتلیال متصل و از طریق اندوسیتوز به سلول منتقل میشود. کمپلکس گیرنده – IgA، قبل از ترشح در سطح مجرای سلولهای اپیتلیال، هنوز به گیرنده متصل است، از طریق محفظههای سلولی عبور میکند. پروتئولیز گیرنده اتفاق میافتد و مولکول دیمری IgA به همراه بخشی از گیرنده معروف به جز ترشحی – معروف به sIgA آزادانه در سراسر لومن پخش میشوند.
در روده، IgA میتواند به لایه مخاطی سلولهای اپیتلیال پوشانده شود. به این ترتیب سد خنثیسازی تهدیدها قبل از رسیدن به سلولهای اپیتلیال ایجاد میشود.
تولید sIgA در برابر آنتیژنهای خاص به نمونهبرداری از سلولهای M و سلولهای دندریتیک زمینهای، فعال شدن سلول T و تغییر کلاس سلول B در GALT، غدد لنفاوی مزانتریک و فولیکولهای لنفاوی جدا شده در روده کوچک بستگی دارد.
sIgA در درجه اول با انسداد گیرندههای اپیتلیال (به عنوان مثال با اتصال لیگاندهای آنها بر روی عوامل بیماریزا)، جلوگیری از اتصال به سلولهای اپیتلیال و با حذف سیستم ایمنی بدن عمل میکند. حذف ایمنی فرآیندی است که با اتصال متقابل آنتیبادی به آنتیبادیها، به دام انداختن آنها در لایه مخاط و یا پاکسازی آنها به صورت پریستالتیک، آنتیژنهای چند ظرفیتی یا پاتوژنها را جمع میکند.
زنجیرههای الیگوساکارید از اجزای IgA، میتوانند با لایه مخاطی که در بالای سلولهای اپیتلیال قرار دارد ارتباط برقرار کنند. از آنجا که sIgA یک اپسونین ضعیف و فعال کننده مکمل است، صرفاً اتصال یک پاتوژن برای مهار آن کافی نیست.
ممکن است لازم باشد که اپیتوپهای خاص به طور استریکی مانع از دسترسی به اپیتلیوم شوند. پاکسازی IgA حداقل تا حدی توسط گیرندههای آسیالوگلیکوپروتئین واسطهای است که IgA – گلیکانهای انتهایی گالاکتوز را تشخیص میدهد.
ایمونوگلوبولین d چیست؟
ایمونوگلوبولین D یا IgD یک ایزوتایپ آنتیبادی مونومر است که در غشای پلاسمایی لنفوسیتهای B نابالغ بیان و همچنین به صورت ترشحی تولید میشود که به مقدار کم در سرم خون وجود دارد. IgD ترشحی از دو زنجیره سنگین کلاس delta و دو زنجیره سبک تشکیل شده است. عملکرد IgD هنوز کاملاً شناخته نشده است.
IgD در گونههای مختلف از ماهی به انسان دیگر وجود دارد (احتمالاً به استثنای پرندگان)، نشان میدهد که IgD از ریشههای باستانی خود حفظ شده است و در نتیجه IgD دارای عملکردهای ایمونولوژیک مهمی است.
IgD برای مشارکت سلولهای B در دفاع ایمنی، فعال میشوند. ظاهرا IgM و IgD این نقش را بر عهده دارند و IgM در چرخه زندگی سلولهای B زودتر از IgD بیان میشود. به خوبی درک نشده است که تفاوت عملکرد IgM و IgD در سلولهای B چیست. مدلهای موش ناک هیچ نقص ذاتی عمدهای نداشتهاند. در حقیقت، زنجیرههای سنگین IgM و IgD توسط یک واحد رونویسی مشترک رمزگذاری میشوند.
رشد و بلوغ سلولهای B در موشهای فاقد ژن IgM، طبیعی است چون عملکرد آنها با IgD، جایگزینِ IgM غشایی و ترشحی میشود. این دادهها حاکی از آن هستند که IgD تا حد زیادی قادر است جایگزین عملکردهای IgM در سلولهای B شود. IgD ظاهراً همچنین میتواند به بازوفیلها و ماست سلها متصل شود و این سلولها را فعال کرده و عوامل ضد میکروبی تولید کند که در دفاع ایمنی تنفسی در انسان نقش دارند.

ایمونوگلوبولین D
آزمایش ایمونوگلوبولین خون
آزمایش ایمونوگلوبولین مقدار انواعی از آنتیبادیها را در خون اندازهگیری میکند. پزشکان ممکن است سطح ایمونوگلوبولین را بررسی کنند تا ببینند آیا فرد عفونت دارد یا از ابتلا به آن عفونت محافظت میکند (در برابر آن ایمن است). پزشکان همچنین از آزمایش ایمونوگلوبولین برای کمک به تشخیص نقص سیستم ایمنی بدن (زمانی که سیستم ایمنی بدن آنطور که باید کار نمیکند) استفاده میکنند.
کودکی که به بسیاری از عفونتهای غیرمعمول مبتلا میشود،مشکوک به نقص ایمنی است و این آزمایش میتواند به عنوان بخشی از ارزیابی آلرژیها یا بیماریهای خود ایمنی مانند آرتریت ایدیوپاتیک نوجوانان، لوپوس و بیماری سلیاک انجام شود. قبل از انجام آزمایش میتوان آب بنوشند مگر اینکه همراه با این تست، آزمایش دیگری نیز داشته باشید که نیاز به ناشتا بودن باشد.
آزمایش ایمونوگولوبولین با رگگیری از دست یا نوک انگشت انجام و خون برای انجام تستهای آزمایشگاهی جمعآوری میشود. نمونه دیگری که برای بررسی ایمونوگلوبینها استفاده میشود مایع مغزی نخاعی (Cerebrospinal Fluid) یا CSF با استفاده از سوزن مخصوص نمونهبرداری است که از ناحیه کمر جمعآوری میشود. این مایع مغز و نخاع را احاطه کرده و از آنها محافظت میکند.
ابتدا پزشک محل نمونهبرداری را بیحس میکند، بیمار به پهلو میخوابد و زانوها را تا کمر به درون شکم خم میکند. پزشک سوزن را بین دو مهره پایین نخاع وارد کرده و مقدار کمی از مایع مغزی نخاعی را به داخل سرنگ میکشد. پزشک ممکن است برای تشخیص عفونت شدید خصوصا عفونت سینوسی، عفونت ریهها، معده یا روده آزمایش ایمونوگلوبولین را تجویز کنند.
در صورت وجود علائم زیر تجویز این تست محتمل است:
- اسهال مداوم که بهبود نمییابد.
- کاهش وزن بدون دلیل مشخص
- تب
- آلرژی یا حساسیت
- راشهای پوستی (جوشهای کوچک قرمز رنگ)
- بروز بیماری پس از سفر
- ابتلا به ایدز، مولتیپل میلوما (نوعی سرطان) یا بیماریهای دیگری که نیاز به بررسی منظم فاکتورها و سلولهای خونی دارند.

تفسیر آزمایش ایمونوگلوبولین
اگرچه کم یا زیاد بودن ایمونوگلوبولین خون به تنهایی، لزوما به معنی ابتلا به یک بیماری خاص نیست اما در اثر مصرف برخی داروها یا ابتلا به بیماریها ممکن است مقادیر ایمونوگلوبینها غیر طبیعی شود. آزمایش ایمونوگلوبولین هر فرد میتواند براساس روشی که آزمایشگاه استفاده میکند، متفاوت باشد.
پایین بودن iga نشانه چیست؟
حدود ۱٪ از جمعیت کمبود جزئی یا کامل IgA دارند که معمولاً بدون علامت است. بیماران ممکن است کمی بیشتر در معرض خطر بیماریهای گوارشی (از جمله بیماری سلیاک)، بیماری خودایمنی یا افزایش عفونتهای سطحی باشند.
پایین بودن igA علتهای مختلفی دارد که در ادامه به برخی از شایعترین و مهمترین آنها یعنی مشکلات ژنتیکی، ابتلا به برخی بیماریها مانند دیابت و نارسایی کلیه، خودایمنی و استفاده از مواد مخدر پرداختهایم.
مشکلات ژنتیکی
کاهش یا عدم وجود IgA به دلیل عدم توانایی ارثی در تولید IgA، کمبود IgA انتخابی نامیده میشود و میتواند نقص ایمنی ایجاد کند. آنتیبادیهای ضد IgA که گاهی در افراد با IgA کم یا غایب وجود دارند، در صورت تزریق با فرآوردههای خونی که به طور اتفاقی حاوی IgA هستند، میتوانند منجر به واکنشهای جدی آنافیلاکتیک شوند. با این حال، بیشتر افرادی که مشکوک به واکنشهای آنافیلاکتیک IgA هستند، واکنشهای حاد عمومی را تجربه کردهاند که علت دیگری غیر از تزریق ضد IgA داشته است.
گونههای نایسریا (Neisseria) شامل نایسریا گونوراسه (Neisseria gonorrhoeae) که باعث سوزاک میشود، استپرتوکوکوس پنومونیا (Streptococcus pneumoniae) و هموفیلوس آنفولانزا (Hemophilus influenzae) است که نوع B همگی، پروتئاز آزاد میکنند که IgA را از بین میبرند. گونههای بلاستوسیستیس دارای چندین زیرگروه هستند که آنزیمهای سیستئین و پروتئاز اسپارتیک را تولید و IgA انسان را تخریب میکنند.
خود ایمنی و واسطه ایمنی
نفروپاتی IgA ناشی از رسوبات IgA در کلیهها است. هنوز مشخص نیست که چرا رسوبات IgA در این بیماری مزمن رخ میدهد. برخی از نظریهها بیانگر وجود ناهنجاری در نتیجه سیستم ایمنی بدن در این رسوبات است. بیماری سلیاک به دلیل وجود آنتیبادیهای ضد جسمی IgA شامل آسیبشناسی IgA است.
پورپورای Henoch – Schönlein (HSP) یک واسکولیت سیستمیک (التهاب در دیواره عروق خونی) است که در اثر رسوب IgA و جز مکمل ۳ (C3) در رگهای خونی کوچک ایجاد میشود.
HSP معمولاً در کودکان کوچک اتفاق میافتد و پوست و بافتهای همبند، بیضه، مفاصل، دستگاه گوارش و کلیهها را درگیر میکند. درماتوز بولوز IgA خطی و پمفیگوس IgA دو نمونه از بیماریهای ایمنی بدن با واسطه IgA هستند. درمان بیماریهای ایمونوبولوس با واسطه IgA اغلب حتی با داروهای معمول موثر مانند ریتوکسیماب نیز ممکن است دشوار باشد.
مواد مخدر
وانکومایسین میتواند باعث ایجاد درماتوز بولوس IgA خطی در برخی از بیماران شود.
مصرف داروها
داروهای که سیستم ایمنی را تضعیف میکنند مانند داروهای استروئیدی و داروهای سرکوب کننده سیستم ایمنی در بیمارانی که پیوند عضو انجام دادهاند و داروهای شیمیدرمانی ممکن است باعث کاهش عملکرد ایمنی بدن در تولید ایمونوگلوبولین ها شوند.
بالا بودن iga نشانه چیست؟
IgA بالاتر از حد نرمال افزایش سطح IgA غیر اختصاصی است اما در بیماریهای التهابی ریوی و دستگاه گوارش، برخی از شرایط خود ایمنی، بیماری کبدی و اختلالات سلولهای پلاسما دیده میشود.

فرق بین igg و igm چیست؟
ایمونوگلوبولینهای خاصی که به همراه آنتیژن آنها به حیوانات تزریق میشود، میتوانند بر پاسخ آنتیبادی به همان آنتیژن تأثیر بگذارند. آنتیبادیهای درونزا که پس از یک واکسیناسیون اولیه تولید میشوند نیز میتوانند بر پاسخ آنتیبادی به واکسیناسیون تقویتکننده اثرگذار باشند و اثرات مشابه در شرایط فیزیولوژیکی رخ میدهند. بر اساس نوع آنتیژن و ایزوتایپ آنتیبادی، این اثر میتواند سرکوب یا افزایش پاسخ آنتیبادی باشد.
این آزمایشات با آزمایشاتی که شامل ایمنسازی با گلبولهای قرمز (گلبولهای قرمز) زنوژنیک (گلبولهای قرمز) است به خوبی نشان داده میشود. به عنوان مثال، وقتی هنگام زایمان، IgG همراه با گلبولهای قرمز تجویز میشود، این ترکیب باعث سرکوب تقریبا کامل پاسخ آنتیبادی مخصوص گلبول قرمز میشود. این اثر از نظر بالینی برای جلوگیری از ایمن سازی مادران Rh منفی در برابر گلبولهای قرمز Rh مثبت استفاده و باعث کاهش چشمگیر بروز بیماری همولیتیک در نوزاد میشود.
در مقابل اثر IgG ،IgM اختصاصی آنتیژن میتواند تا حد زیادی پاسخ آنتیبادی، خصوصاً در مورد آنتیژنهای بزرگ را افزایش دهد. بنابراین، هنگامی که IgM مخصوص گلبولهای قرمز همراه با گلبولهای قرمز به حیوانات (از جمله انسان) تزریق میشود، پاسخ آنتیبادی بسیار قویتری به گلبولهای قرمز نسبت به زمانی که گلبول قرمز به تنهایی تجویز میشود، القا خواهد شد. چندین شواهد نشان میدهند که توانایی IgM برای فعال کردن مکمل برای اثر تقویتکننده آن لازم است.
به این معنی که افزایش واسطه IgM در حیواناتی که برای مؤلفه C3 مکمل تخلیه شدهاند و همچنین در حیوانات جهش یافته فاقد گیرندههای مکمل ۱ و ۲ اتفاق نمیافتد. به همین ترتیب، IgM جهش یافته که نمیتواند مکمل را فعال کند پاسخ ایمنی را افزایش نمیدهد.
توضیح احتمالی برای افزایش واسطه IgM این است که لنفوسیتهای B، کمپلکسهای IgM – آنتیژن مکمل را گرفته و آنها را به مناطقی از طحال که پاسخهای ایمنی کارآمد ایجاد میشود، منتقل میکنند. از آنجا که IgM در اوایل پاسخ ایمنی تولید میشود، این ممکن است در شروع پاسخهای آنتیبادی مهم باشد.
تفسیر آزمایش igg و igm
افزایش سطح IgM نشانگر غیر اختصاصی التهاب است اما میتواند با بیماری کبد همراه باشد. سطح پایین IgM معمولاً غیر اختصاصی است و اهمیت آن به تظاهرات بالینی و سایر پارامترهای آزمایشگاهی بستگی دارد.
افزایش سطح IgG در عفونت یا التهاب فعال مزمن یا همراه با اختلالات سلول های پلاسما دیده می شود. در IgG کمتر از ۲۰ درصد زیر حد نرمال، هیپوگاماگلوبولینمیای خفیف معمولاً غیر اختصاصی است. بهتر است آزمایش بعد از ۳ ماه تکرار شود.
اگر میزان IgG به طور مداوم پایین باشد، شمارش کامل خون باید بررسی شود. IgG بالاتر از ۲۰ درصد زیر حد نرمال، هیپوگاماگلوبولینمیا (کاهش گاما گلوبولین) بوده و اغلب با عفونتهای باکتریایی عود کننده همراه است. بهتر است سرم خون بررسی و علل ثانویه در نظر گرفته شوند.
آمپول ایمونوگلوبین چیست؟
ایمونوگلوبولین داخل وریدی یا IVIg، درمانی با استفاده از ایمونوگلوبولینهای اهدا شده توسط افراد مختلف است و به صورت تزریقی برای بهبود بیماریهای مختلف انجام میشود. IVIg برای کاهش اثرات برخی بیماریهای خود ایمنی و افزایش سطح ایمونوگلوبولینها در افرادی که در اثر بیماری یا داروهای خاص دچار کمبود شدید ایمونوگلوبولین هستند کاربرد دارد.
دوز مناسب IVIg بر اساس وزن و میزان مشکل تجویز و معمولاً به صورت داخل وریدی داده میشود اما اگر فقط برای افزایش سطح ایمونوگلوبولین در کنار سایر روشهای درمانی باشد، به عنوان تزریق هم تجویز میشود.
تزریق چندین ساعت طول خواهد کشید زیرا دارو باید به آرامی وارد رگ شود و هنگام تزریق، باید مرتباً فشار خون، نبض و دمای بدن بررسی شوند. بعد از اتمام تزریق، بیمار باید برای سنجش عوارض جانبی احتمالی، یک ساعت در بیمارستان تحت نظر باشد. تعداد دفعات تزریق IVIg به میزان پاسخ به درمان بستگی دارد.
از جمله این بیماریهایی که ایمونوگلوبولین داخل وریدی برای درمان آنها کاربرد دارد، میتوان به موارد زیر اشاره کرد:
- میوزیت (التهاب عضلانی)
- لوپوس
- بیماری استیل بزرگسالان (Adult-Onset Still’s Disease)
- واسکولیت
- سندرم آنتیفسفولیپید
- سندرم شوگرن

افرادی که IVIg دارند گاهی اوقات در حین تزریق یا پس از آن دچار عوارض جانبی میشوند.
برخی از این علائم عبارتند از:
- تب و لرز
- سردرد
- درد شکم
- استفراغ
- درد مفصل
- کمر درد
- خستگی
در صورت بروز هریک از این علائم، تزریق متوقف میشود و معمولاً پس از آن عارضه به سرعت برطرف خواهد شد. در صورت امکان بهتر است برند تزریقی آمپول آی وی آی جی هر بار یکسان باشد مگر اینکه فرد به یک برند خاص واکنش نشان دهد.
تمام محصولات خونی استفاده شده برای اهدای آنتیبادی از نظر آلودگی به بیماریهایی مانند هپاتیت و عفونتهای دیگر به دقت مورد آزمایش قرار میگیرند. بر اساس دستورالعملهای فعلی IVIg میتواند در دوران بارداری و شیردهی نیز تجویز شود زیرا اثرات مضر آن روی مادر یا نوزاد اثبات نشده است.
انتهای پیام